Введение
В современных научных исследованиях, посвященных процессам комплексообразования, особое внимание уделяется углубленному анализу равновесных характеристик, термодинамических параметров и кинетических особенностей [1, 2]. Эти аспекты представляют фундаментальную основу для множества прикладных областей, включая химию, металлургию и медицину. Данные исследования открывают широкий спектр возможностей для усовершенствования как лабораторных, так и промышленных процессов, связанных с добычей, переработкой и использованием драгоценных, переходных и редкоземельных металлов [3, 4]. Несмотря на прогресс, достигнутый в исследовании этих процессов, все еще сохраняются методологические разрывы и теоретические противоречия, особенно в контексте воздействия таких факторов, как температура, концентрация реагентов и соотношение металл-лиганд, на стабильность и кинетику комплексных соединений.
Термодинамическая составляющая этих исследований фокусируется на изучении изменений энтальпии и энтропии. Для этого широко применяются уравнения Вант-Гоффа и Нернста, которые позволяют количественно оценить влияние температуры на устойчивость комплексов. Например, как показано в работах [5, 6], температурный фактор особенно критичен для формирования стабильных соединений с участием таких драгоценных металлов, как золото и серебро. В то же время кинетические исследования сосредоточены на изучении скорости реакций и активационной энергии, используя уравнение Аррениуса для анализа ключевых параметров, определяющих динамику процессов [7]. Особую значимость они имеют при работе с переходными металлами, такими как медь и никель, которые демонстрируют сложное поведение в кинетических условиях. В контексте редкоземельных металлов, таких как лантан, модели сорбции и массопереноса, основанные на изотермах Ленгмюра, указывают на необходимость создания специфических условий для образования устойчивых комплексов, учитывая высокую химическую активность этих элементов [8].
Однако, несмотря на заметные успехи, в научной литературе сохраняется недостаток исследований, в которых комбинируются термодинамические и кинетические аспекты. Более того, существующие модели часто оказываются недостаточно точными для описания сложных многокомпонентных систем. Дальнейший анализ подтверждает необходимость разработки модифицированных моделей, которые бы объединяли данные о термодинамике, кинетике и процессах массопереноса. Это открывает перспективы не только для углубления теоретических знаний, но и для повышения эффективности практического применения процессов комплексообразования в научной и промышленной среде.
В рамках исследования гипотеза заключается в том, что учет взаимного влияния таких факторов, как температура, электрохимический потенциал, степень адсорбции и соотношение металл-лиганд, позволит предложить модифицированное уравнение равновесия комплексообразования. Такое уравнение должно более точно отражать процессы сорбции и массопереноса, обеспечивая тем самым повышение эффективности извлечения и стабилизации металлов.
Целью работы является разработка усовершенствованной модели равновесия комплексообразования, способной учитывать как термодинамические, так и кинетические параметры для оптимизации процессов сорбции и массопереноса.
Для достижения цели поставлены следующие задачи:
1. Провести детальный анализ зависимости электрохимического потенциала от концентрации металлов, выделив специфические особенности различных групп элементов.
2. Оценить влияние температуры на устойчивость комплексов с использованием уравнения Вант-Гоффа, идентифицируя критические температурные параметры.
3. Разработать и верифицировать модифицированное уравнение, которое интегрирует термодинамические и кинетические аспекты.
Материалы и методы исследования
В исследовании применялся многосторонний подход, базирующийся на интеграции математического моделирования. Важной частью работы стало использование моделей, которые охватывали широкий спектр термодинамических и кинетических параметров. Одновременно с этим особое внимание уделялось учету специфики процессов сорбции и массопереноса. Такой подход обеспечивал детализированное и всестороннее рассмотрение исследуемых явлений с учетом взаимосвязи и влияния различных факторов.
Для анализа устойчивости образующихся комплексов применялись уравнения Вант-Гоффа и Нернста. Эти инструменты позволили глубже понять, как температурные изменения и электрохимический потенциал влияют на равновесие химических систем [9].
Кинетические параметры, включая скорость протекания реакций и энергию активации, были определены с использованием уравнения Аррениуса. Данный подход оказался особенно важным для изучения зависимости процессов комплексообразования от температуры [7]. Анализ сорбционных процессов был проведен с использованием изотермы Ленгмюра, которая, благодаря своей универсальности, давно признана надежным инструментом для моделирования адсорбции различных металлов, включая редкоземельные элементы [8].
Для оценки влияния ограничений, связанных с массопереносом, использовались уравнения диффузии. Это позволило выявить ключевые факторы, определяющие формирование стабильных комплексных соединений [10]. Параметры, относящиеся к разнообразным группам металлов, включая драгоценные, переходные и редкоземельные, определялись на основе информации, представленной в научных источниках. После тщательной обработки данных выполнялись расчеты, реализованные посредством использования программного обеспечения. Такой подход позволял добиться исключительной точности в проведении анализа, минимизируя вероятность статистических или методологических отклонений.
Особое внимание уделялось влиянию таких параметров, как температура, концентрация реагентов и соотношение металл-лиганд. Подобный подход не только позволил минимизировать объем экспериментальных данных, но и обеспечил возможность точного прогнозирования поведения систем комплексообразования. Это, в свою очередь, является ключевым аспектом оптимизации промышленных процессов, направленных на извлечение, переработку и стабилизацию металлов.
Результаты исследования и их обсуждение
В рамках современных научных исследований, направленных на изучение механизмов комплексообразования, особый акцент делается на детальном анализе равновесных характеристик, термодинамических параметров и кинетических закономерностей, определяющих динамику подобных процессов. Глубина понимания данных аспектов во многом обусловливает эффективность применяемых химических методов и технологий.
Настоящее исследование рассматривает математические модели, описывающие процессы формирования устойчивых комплексов, закономерности сорбции и особенности массопереноса. Взаимосвязь между кинетическими параметрами и термодинамическими характеристиками раскрывается через систему фундаментальных уравнений, позволяющих формализовать сложные явления, происходящие в реакционной среде. Среди рассмотренных теоретических основ особое внимание уделено аналитическим зависимостям, предложенным Нернстом, Вант-Гоффом, Аррениусом, а также сорбционным моделям, разработанным Ленгмюром. Их применение обеспечивает возможность глубокой интерпретации процессов, определяющих скорость и эффективность химических превращений.
Детализированное исследование взаимодействий различных групп металлов, включая драгоценные, переходные и редкоземельные элементы, демонстрирует специфику формирования устойчивых координационных структур. Комплексные соединения, образуемые при определенных термодинамических и электрохимических условиях, играют ключевую роль в оптимизации технологических процессов. Глубокий анализ коэффициентов устойчивости координационных соединений, зависимостей электрохимического потенциала и реакционной активности позволяет определить параметры, способствующие максимальной эффективности протекания данных процессов в условиях лабораторных исследований и промышленного производства.
1. Уравнение равновесия комплексообразования
Для процесса комплексообразования M+L ? ML равновесное состояние описывается выражением
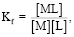 (1)
(1)
где Kf – константа устойчивости комплекса, [M] – равновесная концентрация свободного металла, [L] – равновесная концентрация свободного лиганда, [ML] – равновесная концентрация комплекса.
С учетом ограничений адсорбции и массопереноса эффективные концентрации выражаются как
Meff = [M](1 – θ), Leff = [L](1 – θ), (2)
где θ = Kα[M] / 1 + Kα[M] описывает степень связывания металла на поверхности.
2. Уравнение Вант-Гоффа
Для описания зависимости константы устойчивости комплекса от температуры:
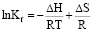 , (3)
, (3)
где ΔH – изменение энтальпии процесса комплексообразования, ΔS – изменение энтропии процесса, R – универсальная газовая постоянная, T – температура в Кельвинах.
3. Уравнение Нернста
Электрохимический потенциал металла в процессе определяется уравнением Нернста:
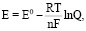 (4)
(4)
где Q = [Mn+] / [M]eff , E0 – стандартный электрохимический потенциал, n – количество электронов, участвующих в реакции, F – постоянная Фарадея.
4. Уравнение изотермы Ленгмюра
Для описания процессов сорбции металлов:
 (5)
(5)
где θ – степень связывания металла, Kα – константа адсорбции, [M] – концентрация металла.
5. Уравнение Аррениуса
Для описания скорости процесса комплексообразования:
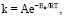 (6)
(6)
где k – скорость реакции, A – предэкспоненциальный фактор, Ea – энергия активации.
В равновесии:
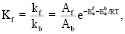 (7)
(7)
что связывает термодинамические параметры с кинетикой реакции.
6. Уравнение массопереноса
При наличии диффузионных ограничений:
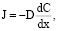 (8)
(8)
где J – поток вещества, D – коэффициент диффузии, dC/dx – градиент концентрации.
Эффективная концентрация свободного металла выражается как
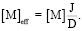 (9)
(9)
7. Модифицированное итоговое уравнение
С учетом всех вышеуказанных факторов итоговая модель принимает следующий вид:
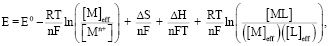 (10)
(10)
где [M]eff и [L]eff учитывают адсорбцию и ограничения массопереноса.
Kf зависит от кинетики реакции (уравнение Аррениуса) и термодинамики (ΔH, ΔS).
На основе модифицированного итогового уравнения разработаны графики, которые наглядно продемонстрируют взаимосвязь между ключевыми параметрами процессов комплексообразования для различных групп металлов. Анализ включает три категории элементов, каждый из которых обладает уникальными характеристиками, требующими отдельного подхода к исследованию.
1. Драгоценные металлы (золото, серебро). Металлы данной группы отличаются высокой стоимостью и значительным практическим применением, особенно в аналитической химии и лабораторных исследованиях. Благодаря уникальным физико-химическим свойствам золото и серебро часто становятся объектами для анализа в процессах комплексообразования. Выявление оптимальных условий для работы с этими металлами имеет первостепенное значение, поскольку их выделение связано с высокой ценностью для науки и промышленности. Рекомендуется сосредоточить внимание на электрохимических характеристиках, таких как стандартный потенциал (E?), для определения наиболее эффективных параметров.
2. Переходные металлы (медь, никель) характеризуются широким распространением и сравнительно низкой стоимостью, что делает эту группу особенно привлекательной для лабораторного изучения. Высокая реакционная способность в процессах ионного обмена и комплексообразования позволяет исследовать различные условия взаимодействия с лигандами. Выбор оптимальных параметров, включая концентрацию и температуру, может повысить эффективность их использования в прикладных и научных экспериментах.
3. Редкоземельные металлы (например, лантан). Особенности этой группы металлов делают их крайне важными для изучения в контексте процессов комплексообразования. Лантан, обладая уникальными химическими и электрохимическими свойствами, представляет значительный интерес для исследователей. Анализ поведения в различных условиях может раскрыть дополнительные аспекты механизмов взаимодействия между металлом и лигандом, что особенно важно для разработки новых материалов или технологий.
Из указанных типов металлов графики будут построены с учетом следующих параметров: стандартный электрохимический потенциал (E?), константа устойчивости комплекса (Kf) и степень адсорбции (Ka).
На рис. 1–3 представлены три зависимости:
? Зависимость электрохимического потенциала от концентрации металла (E в зависимости от M), позволяющая проанализировать изменения редокс-характеристик при варьировании концентрации.
? Зависимость устойчивости комплекса от температуры (Kf в зависимости от T), отражающая влияние термодинамических условий на формирование и стабильность комплекса.
? Зависимость выхода комплекса от соотношения металл-лиганд (Зависимость выхода комплекса от соотношения M/L), демонстрирующая, как различные пропорции компонентов влияют на эффективность комплексообразования.
Эти графические данные помогут углубить понимание процессов взаимодействия металлов с лигандами и разработать рекомендации для оптимизации условий применения.
На основании данных, представленных на рис. 1, можно заметить, что электрохимический потенциал E металлов демонстрирует тенденцию к снижению по мере увеличения концентрации [M], что вполне согласуется с теоретическими положениями, описанными уравнением Нернста.
Примечательно, что золото и серебро обладают значительно более высокими значениями потенциала E, что обусловлено выдающимися стандартными электрохимическими характеристиками. Такое поведение свидетельствует об исключительной стойкости к окислительным процессам.
В то же время металлы, относящиеся к группе переходных, медь и никель, характеризуются умеренными значениями электрохимического потенциала, что подчеркивает их промежуточные свойства между благородными и высокоактивными элементами. На другом конце спектра располагается редкоземельный металл лантан, он демонстрирует наименьшее значение потенциала E, что указывает на значительную химическую активность и склонность к окислению.
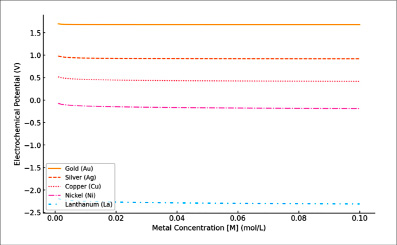
Рис. 1. Зависимость электрохимического потенциала от концентрации металлов (E vs. M)
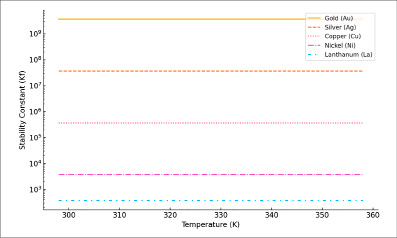
Рис. 2. Зависимость устойчивости комплекса от температуры (Kf vs. T)
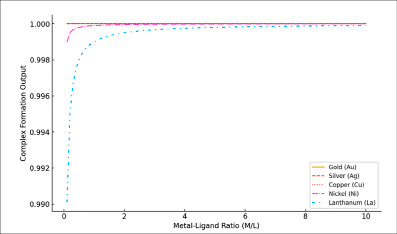
Рис. 3. Влияние соотношения металл-лиганд на образование комплекса (выход комплекса vs. M/L)
Как демонстрирует рис. 2, стабильность комплексов, выраженная через коэффициент устойчивости (Kf), проявляет значительную изменчивость в зависимости от конкретного металла. В частности, золото и серебро выделяются наивысшими показателями Kf, что указывает на заметную способность формировать устойчивые комплексы. Переходные металлы медь и никель занимают промежуточное положение по величине Kf, что говорит о средней склонности к стабильному комплексообразованию. Редкоземельный элемент лантан характеризуется минимальным значениям Kf, демонстрируя ограниченную предрасположенность к созданию прочных комплексов.
Анализ подтверждает, что величина Kf остается практически неизменной в пределах исследуемого температурного диапазона. Это явление можно объяснить тем, что рассматриваемые процессы относятся к категории термодинамически стабильных и не подвержены значительным температурным воздействиям в указанных условиях.
Как показывает рис. 3, выход комплекса металл-лиганд (ML) напрямую зависит от соотношения металл-лиганд (M/L), и эта зависимость варьируется в зависимости от природы металла. Интересно, что такие металлы, как золото, серебро и медь, демонстрируют почти мгновенное достижение насыщения при низких значениях M/L. Это указывает на высокую способность к комплексообразованию и стабильность образующихся комплексов. Однако для металлов вроде никеля и особенно лантана требуется значительно большее значение M/L, чтобы достичь максимального выхода. Этот феномен связан с меньшими значениями константы устойчивости их комплексов (Kf), что подчеркивает разницу в химических свойствах металлов и влияние на процессы комплексообразования при варьирующихся концентрациях.
Проведенный кинетический анализ, базирующийся на уравнении Аррениуса, позволил рассчитать скорость реакции и активационную энергию для различных металлов. Интересно отметить, что переходные металлы показали средние значения скорости реакции, что согласуется с промежуточным положением в ряду активности металлов. Дополнительно сорбционный анализ с использованием изотерм Ленгмюра выявил, что редкоземельные металлы, такие как лантан, требуют значительно более высоких концентраций для достижения заметного уровня связывания, что подчеркивает специфические сорбционные свойства.
Значительным достижением стало исследование массопереноса, которое выявило ключевую роль концентрационных градиентов в эффективности процессов. Особенно это проявляется в системах с высокой химической активностью, где неравномерное распределение концентраций может существенно замедлить скорость реакции. Эти данные подчеркивают необходимость учета процессов массопереноса при создании единой модели, описывающей взаимодействия металл-лиганд.
В целом результаты работы не только подтверждают основные тенденции, наблюдаемые ранее, но и указывают на существующие пробелы в понимании кинетики комплексообразования редкоземельных металлов. Также остается малоизученным влияние сложных лигандных структур на эти процессы. В качестве перспективных направлений для дальнейших исследований выделяются изучение кинетических параметров для многокомпонентных систем, а также углубленный анализ взаимодействий металл-лиганд в условиях сложных химических сред.
Заключение
В представленном исследовании предложена усовершенствованная модель равновесия процессов комплексообразования, которая учитывает совокупность термодинамических и кинетических факторов, а также механизмы сорбции и массопереноса. Центральное место в работе занимает разработка универсального математического уравнения, способного интегрировать ключевые аспекты этих процессов, обеспечивая тем самым более точное описание механизмов образования комплексов для различных категорий металлов.
Анализ позволил выделить несколько важных результатов, которые заслуживают отдельного рассмотрения:
1. Термодинамические особенности. Драгоценные металлы показали наибольшую устойчивость в процессах комплексообразования, что подтверждает предрасположенность к формированию стабильных структур даже в условиях изменяющихся параметров среды. В то же время редкоземельные металлы демонстрируют зависимость от специфических условий – в частности, температурного режима и концентрации реагентов, что делает их более сложными объектами для практической реализации процессов.
2. Кинетика реакций. Применение уравнения Аррениуса позволило не только определить скорости реакций, но и рассчитать энергию активации для каждой из исследуемых групп металлов. Особый интерес представляет поведение переходных металлов, которые обладают средней скоростью реакций, удобной для применения в ионообменных технологиях. Это открывает широкие перспективы для их использования в промышленной сфере.
3. Сорбционные механизмы. Проведенное исследование изотерм сорбции на основе модели Ленгмюра показало, что для редкоземельных металлов требуются более высокие концентрации, чтобы достичь значимого уровня связывания. Эти данные подчеркивают необходимость тщательной оптимизации параметров адсорбции для повышения эффективности извлечения металлов из сложных систем.
4. Массоперенос и его влияние. Установлено, что концентрационные градиенты и ограничения, связанные с процессами массопереноса, играют ключевую роль в эффективности комплексообразования. Данный эффект наиболее выражен в системах, характеризующихся высокой химической активностью, где массоперенос становится определяющим фактором.
Разработанная модель не только расширяет теоретические представления о закономерностях процессов комплексообразования, но и имеет прикладную значимость и создает фундамент для дальнейшего совершенствования технологий выделения, очистки и стабилизации металлов, обеспечивая надежные инструменты для анализа многокомпонентных систем.


 science-review.ru
science-review.ru